W leczeniu stomatologicznym często spotykamy się z wąskim spojrzeniem na problem. Jama ustna traktowana bywa jako narząd oderwany od reszty ciała a zęby widziane są jako osobne jednostki. Takie spojrzenie uniemożliwia kompletne rozwiązanie wielu problemów zdrowotnych. To podejście powoli ulega zmianie. Jego błędność zaczyna być dostrzegana w literaturze i wielu dentystów stara się patrzeć szerzej. Rośnie też świadomość pacjentów. Całościowe spojrzenie skupia się na szerokiej gamie czynników, na których opiera się Koncepcja 6 Filarów. Jedną z najważniejszych, lecz najczęściej pomijanych kwestii stanowi zgryz. Jego uwzględnienie jest niezbędne do osiągnięcia trwałej i funkcjonalnej odbudowy zębów, nawet jeśli jest ona minimalna. Zgryz decyduje o odczuwalnym komforcie pacjenta i zdrowiu stawów skroniowo-żuchwowych. Zlekceważony, może stanowić źródło dolegliwości bólowych, mięśniowych i posturalnych. Jednak jego wpływ nie ogranicza się do tego. Badania pokazują, że istotnie wiąże się ze zdrowiem mózgu i układem hormonalnym, regulującym m.in. poziom stresu, na czym skupia się ten artykuł.
Zgryz/okluzja – czym jest?
Zgryz, lub inaczej okluzja, określa to jak górne i dolne zęby składają się ze sobą i jak poruszają się względem siebie. Wydaje się to proste i nie znaczące, ale w praktyce jest zupełnie odwrotnie.
Żeby zrozumieć to, dlaczego okluzja jest tak ważna i złożona trzeba przyjrzeć się mechanizmowi zgryzu. Na pierwszy rzut oka wydaje się, że jedyny czynnik determinujący to jak składają się zęby, to ich budowa. Rzeczywiście, zazwyczaj zęby składają się tak, żeby ich guzki lądowały między sobą i zakleszczały się o siebie. Dla większości osób tworzą stabilną i wygodną pozycję, jednak czasami może tak nie być
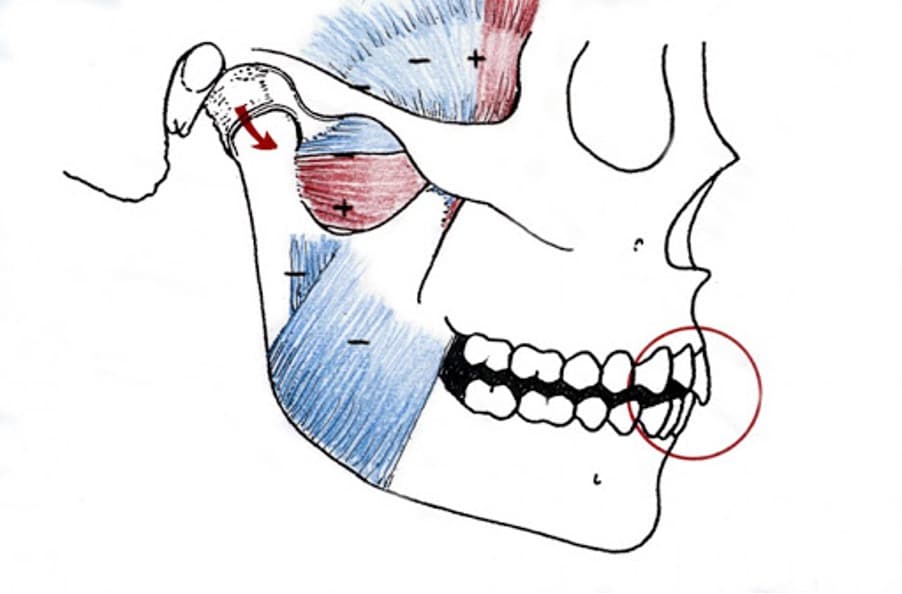
Co naprawdę determinuje zgryz?
Najważniejszym determinantem okluzji jest staw skroniowo-żuchwowy, czyli staw znajdujący się na wysokości ucha, łączący dolną szczękę z górną i pozwalający na otwieranie ust. Ten staw, ze względu na swoją anatomiczną lokalizacją, szeroką gamę ruchów (dolna szczęka rusza się prawie we wszystkich kierunkach, i żaden z tych ruchów nie może blokować dróg oddechowych znajdujących się tuż za nią) ma dość skomplikowaną budowę różniącą się od innych stawów. Budowa stawu musi być też przystosowana do przyjmowania dużych sił powstających podczas przeżuwania (Dawson, 2006).
Mięśnie, które odpowiadają za poruszanie żuchwą też muszą być przystosowane do szczególnych warunków – oprócz wysokiej siły i przyzwyczajenia do ciągłej pracy muszą bardzo dokładnie ją kontrolować, tak by nie ukruszyć delikatnych zębów.
Tę kontrolę umożliwiają receptory znajdującym się wokół zębów, w mięśniach i w stawie, które dzięki wielu połączeniom nerwowym wysyłają sygnały do mózgu (Dawson, 2006).
Czym jest prawidłowy zgryz i dlaczego jest ważny?
Pozycja, w której staw jest stabilny i zdolny do przyjmowania ciężarów, mięśnie zrelaksowane, a zęby chronione, jest ściśle określona. Gdy te warunki są spełnione, można mówić o prawidłowym zgryzie.
Żeby wszystko dobrze ze sobą funkcjonowało, staw i mięśnie muszą być w dobrej pozycji, a to, jak składają się zęby musi im to umożliwić. Małe zmiany w tym, jak składają się ze sobą zęby szybko wykrywane są przez receptory i prowadzą do zmienionej i niestabilnej pozycji stawu, co wywołuje nieskoordynowane napięcia mięśni, zaburzając ich pracę. Oprócz tego, że może wywoływać stałe napięcie i bóle naraża zęby na nieprawidłowe „zazębianie”. To może doprowadzić do starć, ukruszeń, bólu i szybkich niepowodzeń w trwałości wypełnień, koron, mostów, implantów i innych odbudów (Dawson, 2006). Zaburzenia w okluzji mogą prowadzić też do wielu innych problemów. Okazuje się, że jednym z organów, na który może mieć duży wpływ jest mózg (Ohkubo et al., 2013).
Czy zgryz może wpływać na zdrowie mózgu?

Związek zgryz-mózg
Odpowiednie funkcjonowanie zgryzu wymaga bardzo dobrej koordynacji od strony mózgu. Jak wcześniej wspomniano, wokół mięśni, w zębach i w stawie skroniowo-żuchwowym znajduje się wiele receptorów, które dzięki wielu połączeniom nerwowym, wysyłają sygnały do mózgu. Jak widać na grafice homunculus, za obszar jamy ustnej odpowiada spora część kory mózgowej. Badania korzystające z funkcjonalnego obrazowania MRI, pokazują dokładnie, które elementy mózgu aktywowane są podczas rożnych czynności, jak przeżuwanie czy poruszanie językiem (Bear, Connors and Paradiso, 2015).


Czy przeżuwanie może wpływać na pamięć i zdolność do nauki?
Kserostomia, czyli niewystarczająca produkcja śliny, może mieć dalekosiężne sPodczas gryzienia stymulowane są obszary mózgu (hipokamp i kora przedczołowa) odpowiedzialne za pamięć, planowanie, podejmowanie decyzji oraz zdolności do nauki (Hirano et al., 2008). Zwiększa się w tych rejonach przepływ krwi i dotlenienie. Przeżuwanie przy poprawnym zgryzie jest potrzebne, żeby regularnie stymulować te rejony mózgu. Jeśli tej stymulacji nie ma, komórki nerwowe hipokampu ulegają zniszczeniu (Terasawa et al., 2002; Aoki et al., 2005; Kubo et al., 2005).

Braki zębów a zdolność do nauki i degeneracja mózgu
Badania na szczurach wykazały, że gdy zdolność do przeżuwania spada, spada też umiejętność nauki i zapamiętywania (Umeda et al., 1995; Kato et al., 1997; Yamazaki et al., 2008). Gdy zęby zostały odbudowane, umiejętność uczenia się znowu wzrosła (Watanabe et al., 2002).
Badania na zwierzętach wykazały też, że gorsza zdolność do przeżuwania mierzalnie wpływa na biochemię mózgu. Zmiany odnotowano w ekspresji genów, produkcji i funkcji najważniejszych neuroprzekaźników, jak acetylocholina i dopamina oraz w powstawaniu komórek mózgowych (Kato et al., 1997; Makiura T, Ikeda Y, Hirai T, Terasawa H, Hamaue N, 2000; Onozuka et al., 2002; Terasawa et al., 2002; Kushida et al., 2008). Wpływa też na powstawanie w mózgu cytokin zapalnych prowadzących do degeneracji i starzenia się tego narządu. (Ono et al., 2005).
Badania na ludziach w tym temacie są ograniczone, ze względu na walory etyczne, ale niektóre wykazały, że przeżuwanie podczas żucia gumy zwiększa przepływ krwi przez konkretne rejony mózgu i poprawia zdolności myślowe. Potrzeba jednak więcej badań biorących pod uwagę inne powiązane czynniki (Ohkubo et al., 2013).
Czym jest dysharmonia zgryzu?
Dla zdrowia mózgu liczy się nie tylko ilość i funkcjonalność zębów, ale też poprawność zgryzu. Gdy zgryz jest zaburzony, pozycja stawu niestabilna a napięcia mięśniowe nieskoordynowane, można mówić o dysharmonii zgryzu (Dawson, 2006).
Dysharmonia może wystąpić naturalnie lub w wyniku jakichkolwiek procedur zmieniających zgryz – np. wypełnienia, leczenie ortodontyczne, utrata zębów, odbudowa protetyczna zębów.
Dysharmonia zgryzu a zdolności do nauki i stres
Badania wykazały, że dysharmonia zgryzu u myszy spowodowana przez zmianę wysokości niektórych zębów o 0.1 mm mocno zaburzyła ich zdolność do nauki (Arakawa et al., 2007).
Dysharmonia zgryzu wywołuje też chroniczny stres. Badania na gryzoniach i małpach pokazały, że wywołanie dysharmonii zgryzu powoduje niemal natychmiastowy wzrost kortyzolu (czyli hormonu stresu) we krwi. Podwyższony poziom stresu utrzymywał się tygodniami i spadł dopiero po przywróceniu poprawnego zgryzu (Budtz‐Jorgensen, 1980; Yoshihara, Matsumoto and Ogura, 2001; Yoshihara, Taneichi and Yawaka, 2009). Autorzy wywnioskowali, że dysharmonia zgryzu wpływa na oś podwzgórze-przysadka-nadnercza, czyli główne centrum regulujące hormony stresu (Ono et al., 2005).
U zwierząt dysharmonia zgryzu wpływa też na produkcję dopaminy (regulującej poziom przyjemności) i noradrenaliny (regulującej stres) (Areso et al., 1999; Yoshihara, Matsumoto and Ogura, 2001).
Długoterminowe wydzielanie kortyzolu ma też degeneracyjny wpływ na hipokamp i może wpływać na zdolności do nauki (Ono et al., 2005).

Zgryz a demencja
Badanie epidemiologiczne pokazują, że utrata zębów i nieadekwatne protezy bezpośrednio wiążą się z pogarszaniem się demencji. Nie wiadomo jednak dokładnie jak dokładają się do tego inne powiązane czynniki (Stein et al., 2007; Bear, Connors and Paradiso, 2015).
Dowiedziono jednak, że umożliwienie wywierania większej siły podczas gryzienia dzięki protezom wspomaga ukrwienie i funkcjonowanie mózgu. Te dane sugerują, że zadbanie o odpowiedni zgryz i przeżuwanie może być prostym sposobem na prewencję (Ohkubo et al., 2013).
Podsumowanie badań
Mimo, że badania na temat związku zgryzu z mózgiem nie cieszą się jeszcze dużą popularnością i wiele danych zebranych jest z badań u zwierząt, można być pewnym, że zgryz i przeżuwanie wysyłają multum informacji do mózgu. Dane sugerują, że odpowiedzialne są za utrzymywanie zdolności do nauki i zapamiętywania przez hipokamp.
Utrata zębów i dysharmonia zgryzu to potencjalne stresory zaburzające regulację hormonów stresu i funkcji hipokampu (Ono et al., 2005).
Potrzebnych jest więcej badań na ludziach, które potwierdzą związek przyczynowo skutkowy, ale korelacja między zgryzem, przeżuwaniem a zdrowiem i funkcją mózgu jest niezaprzeczalna (Ohkubo et al., 2013). Stanowi ona kolejny powód, dla którego warto zadbać o poprawny zgryz w trakcie leczenia stomatologicznego.

Leczenie zgryzu w naszej klinice
W naszej klinice staramy się o to, żeby nie pomijać żadnego aspektu holistycznego leczenia. Dlatego stworzyliśmy koncepcję 6 Filarów, na której opieramy się podczas leczenia każdego pacjenta, i której jednym elementem jest Funkcja. Patrząc na funkcję, patrzymy głównie na zgryz. Podczas wizyty diagnostycznej, prowadzimy wstępną analizę zgryzu a podczas leczenia bardzo uważnie pilnujemy, aby go nie zaburzać. W przypadku dysharmonii zgryzu mamy możliwość przeprowadzenia maksymalnie precyzyjnej analizy zgryzu i pozycji stawu skroniowo-żuchwowego korzystając z aksjografii cyfrowej – najbardziej nowoczesnej i uznanej technologii obecnie dostępnej. Opcje leczenia są różne w zależności od przypadku i preferencji pacjenta. Mogą być to małe korekty zębów, specjalistycznie dobrana i optymalnie zaprojektowana przezroczysta szyna zębowa lub kompletna odbudowa zębów. W przypadku kompletnej odbudowy zębów, analizowane są wyniki aksjografii i na podstawie tego i analizy estetycznej projektowany jest nowy kształt zębów, który ma na celu zapewnić poprawny i stabilny zgryz. Optymalizowany jest tak, by zapewnić najlepsze rozwiązanie funkcjonalne i zgryzowe, jednocześnie dbając o zminimalizowanie inwazyjności preparacji i zapewnienie naturalnego wyglądu.
Bibliografia
Aoki, H., Kimoto, K., Hori, N. and Toyoda, M. (2005) ‘Cell proliferation in the dentate gyrus of rat hippocampus is inhibited by soft diet feeding’, Gerontology. Gerontology, 51(6), pp. 369–374. doi: 10.1159/000088700.
Arakawa, Y., Ichihashi, Y., Iinuma, M., Tamura, Y., Iwaku, F. and Kubo, K. Y. (2007) ‘Duration-dependent effects of the bite-raised condition on hippocampal function in SAMP8 mice’, Okajimas Folia Anatomica Japonica. Okajimas Folia Anat Jpn, 84(3), pp. 115–119. doi: 10.2535/ofaj.84.115.
Areso, M. P., Giralt, M. T., Sainz, B., Prieto, M., García-Vallejo, P. and Gómez, E. M. (1999) ‘Occlusal Disharmonies Modulate Central Catecholaminergic Activity in the Rat’, Journal of Dental Research. Intern. and American Associations for Dental Research, 78(6), pp. 1204–1213. doi: 10.1177/00220345990780060301.
Bear, M. F., Connors, B. W. and Paradiso, M. A. (2015) Neuroscience: Exploring the brain: Fourth edition, Neuroscience: Exploring the Brain: Fourth Edition.
Budtz‐Jorgensen, E. (1980) ‘A 3‐month study in monkeys of occlusal dysfunction and stress’, European Journal of Oral Sciences. Scand J Dent Res, 88(3), pp. 171–180. doi: 10.1111/j.1600-0722.1980.tb01211.x.
Dawson, P. E. (2006) Functional Occlusion, From TMJ to Smile Design, Elsevier. Available at: https://www.elsevier.com/books/functional-occlusion/dawson/978-0-323-03371-8 (Accessed: 3 March 2021).
Hirano, Y., Obata, T., Kashikura, K., Nonaka, H., Tachibana, A., Ikehira, H. and Onozuka, M. (2008) ‘Effects of chewing in working memory processing’, Neuroscience Letters. Neurosci Lett, 436(2), pp. 189–192. doi: 10.1016/j.neulet.2008.03.033.
Kato, T., Usami, T., Noda, Y., Hasegawa, M., Ueda, M. and Nabeshima, T. (1997) ‘The effect of the loss of molar teeth on spatial memory and acetylcholine release from the parietal cortex in aged rats’, in Behavioural Brain Research. Elsevier B.V., pp. 239–242. doi: 10.1016/S0166-4328(97)86078-0.
Kubo, K. Y., Iwaku, F., Watanabe, K., Fujita, M. and Onozuka, M. (2005) ‘Molarless-induced changes of spines in hippocampal region of SAMP8 mice’, Brain Research. Brain Res, 1057(1–2), pp. 191–195. doi: 10.1016/j.brainres.2005.07.038.
Kushida, S., Kimoto, K., Hori, N., Toyoda, M., Karasawa, N., Yamamoto, T., Kojo, A. and Onozuka, M. (2008) ‘Soft-diet feeding decreases dopamine release and impairs aversion learning in Alzheimer model rats’, Neuroscience Letters. Neurosci Lett, 439(2), pp. 208–211. doi: 10.1016/j.neulet.2008.05.017.
Makiura T, Ikeda Y, Hirai T, Terasawa H, Hamaue N, M. (2000) Influence of diet and occlusal support on learning memory in rats behavioral and biochemical studies, Res Commun Mol Pathol Pharmacol. Available at: https://www.researchgate.net/publication/11858039_Influence_of_diet_and_occlusal_support_on_learning_memory_in_rats_behavioral_and_biochemical_studies (Accessed: 3 March 2021).
Ohkubo, C., Morokuma, M., Yoneyama, Y., Matsuda, R. and Lee, J. S. (2013) ‘Interactions between occlusion and human brain function activities’, Journal of Oral Rehabilitation. J Oral Rehabil, pp. 119–129. doi: 10.1111/j.1365-2842.2012.02316.x.
Ono, T., Hamamura, M., Honda, K. and Nokubi, T. (2005) ‘Collaboration of a dentist and speech-language pathologist in the rehabilitation of a stroke patient with dysarthria: a case study.’, Gerodontology, 22(2), pp. 116–119. doi: 10.1111/j.1741-2358.2005.00057.x.
Onozuka, M., Watanabe, K., Fujita, M., Tomida, M. and Ozono, S. (2002) ‘Changes in the septohippocampal cholinergic system following removal of molar teeth in the aged SAMP8 mouse’, Behavioural Brain Research. Behav Brain Res, 133(2), pp. 197–204. doi: 10.1016/S0166-4328(02)00006-2.
Stein, P. S., Desrosiers, M., Donegan, S. J., Yepes, J. F. and Kryscio, R. J. (2007) ‘Tooth loss, dementia and neuropathology in the Nun Study’, Journal of the American Dental Association. American Dental Association, 138(10), pp. 1314–1322. doi: 10.14219/jada.archive.2007.0046.
Terasawa, H., Hirai, T., Ninomiya, T., Ikeda, Y., Ishijima, T., Yajima, T., Hamaue, N., Nagase, Y., Kang, Y. and Minami, M. (2002) ‘Influence of tooth-loss and concomitant masticatory alterations on cholinergic neurons in rats: Immunohistochemical and biochemical studies’, Neuroscience Research. Neurosci Res, 43(4), pp. 373–379. doi: 10.1016/S0168-0102(02)00063-9.
Umeda, K., Sawaki, Y., Kato, T., Usami, T., Ueda, M. and Nabeshima, T. (1995) ‘Effect of tooth loss on spatial learning and memory abilities in adult rats: Implications for central acetylcholine’, undefined.
Watanabe, K., Ozono, S., Nishiyama, K., Saito, S., Tonosaki, K., Fujita, M. and Onozuka, M. (2002) ‘The molarless condition in aged SAMP8 mice attenuates hippocampal Fos induction linked to water maze performance’, Behavioural Brain Research. Behav Brain Res, 128(1), pp. 19–25. doi: 10.1016/S0166-4328(01)00268-6.
Yamazaki, K., Wakabayashi, N., Kobayashi, T. and Suzuki, T. (2008) ‘Effect of tooth loss on spatial memory and TrkB-mRNA levels in rats’, Hippocampus. Hippocampus, 18(6), pp. 542–547. doi: 10.1002/hipo.20440.
Yoshihara, T., Matsumoto, Y. and Ogura, T. (2001) ‘Occlusal disharmony affects plasma corticosterone and hypothalamic noradrenaline release in rats’, Journal of Dental Research. Intern. and American Associations for Dental Research, 80(12), pp. 2089–2092. doi: 10.1177/00220345010800121301.
Yoshihara, T., Taneichi, R. and Yawaka, Y. (2009) ‘Occlusal disharmony increases stress response in rats’, Neuroscience Letters. Elsevier, 452(2), pp. 181–184. doi: 10.1016/j.neulet.2009.01.059.